一、本课程共十九章,55个教学微视频,视频总时长达610分钟。
二、本课程共76个学时,2学分。
三、本课程配套线下教材为《生物化学与分子生物学》,人卫第九版。
四、教学计划如下:
(1) 第一至五章:结构生物化学。 (2) 第六至十二章:代谢生物化学。
(3) 第十四至十八章:遗传信息的表达与调控。 (4) 第十九至二十五章:分子医学。
五、授课方式介绍
线上与线下相结合。
六、成绩评价: 采用过程性评价与终结性评价相结合的线上评价体系;
线上评议成绩是以“视频观看时长、完成作业、测试、考试、笔记及论坛发帖”之成绩为计算依据,分数占比如下:
(1)视频观看 占30%
(2)作业成绩 占20%
(3)测验成绩 占20%
(4)考试成绩 占20%
(5)笔记及发帖讨论成绩 占 10%
七、推荐教材及参考书:
推荐教材:
周春燕、药立波主编,生物化学与分子生物化学 第9版,人民卫生出版社,2018
陈秀芳主编,医学生物化学与分子生物学实验指导,高等教育出版社,2013
参考书:
周春燕、药立波主编,生物化学与分子生物化学 第8版,人民卫生出版社,2013
赵宝昌主编,生物化学 第2版,高等教育出版社,2009
王镜岩主编,生物化学上下册 第3版,高等教育出版社,2009
DM Vasudevan, S Sreekumari, KannanVaidyanathan. Textbook of Biochemistry for Medical Students (Seventh Edition), Jaypee Brothers Medical Publishers, 2013. ISBN-13: 9789350905302
Denise R Ferrier. Biochemistry (Sixth Edition),Lippincott Williams & Wilkins, 2013. ISBN: 9781469836898 (1469836890)
八、课程考核方法与要求:
形成性评价考核,总分100分。包括阶段性理论考核(考易网络题库与考试系统进行两次机考,分别是“结构生物化学”和“代谢生物化学”内容,各占总分的10%(考核成绩为该阶段线上线下相结合的加权分);终结性考核(学期期末进行闭卷考试,占总分60%);实验评分占总分的20%,含(出勤情况+平时表现+实验报告完成情况等)60% + 实验操作考查40%。
九、教学内容纲要
第一章 绪 论
(一)掌握 生物化学的概念。
(二)熟悉 本教材的主要内容及讲授安排。
(二)了解 生物化学发展简史、当代生物化学与分子生物学研究的主要内容及生物化学与分子生物学和医学。
第一篇 生物大分子的结构与功能
第二章 蛋白质的结构与功能
第一节 蛋白质的分子组成
(一)掌握 蛋白质的元素组成及其应用,组成蛋白质的二十种氨基酸的结构通式,掌握部分氨基酸(Asp、Glu、Arg、Lys、His、Pro、Cys、Ser、Thr、Tyr、Met)的侧链功能基团(R基团),氨基酸紫外吸收(基团,波长),肽键结构及反式构型、肽链两端的概念及肽链书写方法。
(二)熟悉 熟悉生物大分子的概念及其在生命现象中的重要作用,二十种基本氨基酸的分类,多肽链、肽及多肽的定义,GSH的组成及生物学功能。
(三)了解 蛋白质在生物体中的重要性及其特点,一些重要的生物活性肽(多肽类激素、神经肽)生物活性肽的作用,蛋白质的分类。
第二节 蛋白质的分子结构
(一)掌握 蛋白质一级结构的概念、组成和化学键,蛋白质二级结构的概念、组成、分类、化学键及α-螺旋的结构要点,蛋白质三级结构的概念、化学键,结构域的概念,蛋白质四级结构的概念、化学键。
(二)熟悉 肽单元的概念,β-折叠及β-转角、Ω-环的结构要点,结构模及其常见形式(锌指、亮氨酸拉链等),影响二级结构形成的主要因素,结构域。
(三)了解 胰岛素分子的一级结构,蛋白质二种常用分类方法,Hb分子的四级结构概况。
第三节 蛋白质结构与功能的关系
(一)掌握 一级结构是空间构象的基础,分子病的发病机理。
(二)熟悉 Hb和Mb氧解离曲线,协同效应及别构效应,蛋白质构象病机理。
(三)了解 蛋白质的功能,一级结构与功能的关系,Hb和Mb分子的空间结构要点,蛋白质空间结构与功能的关系。
第四节 蛋白质的理化性质
(一)掌握 蛋白质两性电离及等电点的概念及应用;蛋白质分子的亲水胶体性质,稳定因素;蛋白质变性的概念、变性因素、变性原理及变性在医学上的应用,蛋白质的理化性质;蛋白质在紫外光谱区有特征性吸收峰。
(二)了解 应用蛋白质呈色反应可测定溶液中蛋白质含量。
第五节 蛋白质的分离、纯化与结构分析 (p.449)
(一)掌握 分子筛原理。
(二)了解 沉淀、盐析、电泳、层析、超速离心等分离纯化蛋白质的方法;蛋白质的一级结构分析,蛋白质的空间结构分析。
第三章 核酸结构与功能
第一节 核酸的化学组成及一级结构
(一)掌握 核酸分子的基本组成,基本单位,DNA和RNA在组成上的异同;核酸一级结构的概念、化学键;DNA与RNA在一级结构上的异同。
核酸中的碱基成分,戊糖与核苷核苷酸的结构和命名。
(二)熟悉 核苷酸的功能。
第二节 DNA的空间结构与功能
(一)掌握 Watson和Crick提出的DNA双螺旋结构模型要点(反向互补、右双螺旋、氢键及碱基堆积力维系)及碱基互补规律的概念及其重要意义;真核DNA超螺旋结构基本单位(核小体)的结构及组蛋白的种类;DNA的基本生物学功能。
(二)熟悉 Chargaff规则;原核生物环状DNA分子的超螺旋结构。
(三)了解 DNA结构的多样性(B-DNA、Z-DNA、A-DNA)及DNA的多链结构。
第三节 RNA的空间结构与功能
(一)掌握 真核生物mRNA的结构特点(ORF及UTR),hnRNA是mRNA的前体;mRNA生物学功能;tRNA的结构特点(富含稀有碱基、二级结构为三叶草结构、三级结构为倒“L”型结构)及其生物学功能;rRNA的结构特点及其生物学功能。
(二)熟悉 组成性非编码RNA、调控性非编码RNA的种类及生物学功能。
(二)了解 tRNA的三级结构;原核生物和真核生物rRNA的种类及核糖体的构成;小核仁RNA和小胞质RNA的名称及主要功能;核酶。
第四节 核酸的理化性质
(一)掌握 碱基对紫外光的吸收性质;DNA变性的概念、Tm值、增色效应(高色效应)的概念及(G+C)与Tm之间的联系。
(二)熟悉 变性DNA复性的概念、核酸分子杂交的概念及常见形式。
(三)了解 核酸的一般理化性质。
第五节 核酸酶
(一)掌握 核酸酶的概念。
(二)了解 核酸酶的种类。
第三章 酶与酶促反应
第一节 酶的分子结构与功能
(一)掌握 结合酶的组成及其功能;酶的活性中心、必需基团的概念、组成及功能;同工酶的概念及乳酸脱氢酶的分型及特点。
(二)熟悉 单体酶、寡聚酶、多酶体系、多功能酶(串联酶)的含义;单纯酶、结合酶的概念。
(三)了解 金属酶、金属激活酶的概念。
第二节 酶的工作原理
(一)掌握 酶促反应特点。
(二)熟悉 酶-底物复合物的形成与诱导契合假说。
(三)了解 酶能有效地降低反应活化能。
第三节 酶促反应动力学
(一)掌握 底物浓度对酶促反应速率影响的曲线类型、米氏方程式、Km的概念、Km及Vmax的生理学意义;酶浓度对酶促反应速率影响的曲线类型;温度对酶促反应速率影响的曲线类型及机理,最适温度的概念及相关例子;pH对酶促反应速率影响的曲线类型及机理,最适pH的概念及相关例子;抑制剂的概念,不可逆性抑制剂的概念及相关例子,可逆性抑制剂的概念及分类,三类可逆性抑制(竞争、非竞争、反竞争)的概念、特点及动力学特征;酶激活剂的概念及分类。
第四节 酶的调节
(一)掌握 酶原及酶原激活的概念、实例、机理和重要生理意义;酶活性的调节。
(二)熟悉 别构调节、别构酶、别构部位、化学修饰调节的概念。
(三)了解 诱导作用、阻遏作用的概念。
第五节 酶的分类与命名
(一)熟悉六大类酶(按顺序记忆)。
(二)了解 酶编号(EC)的含义
第六节 酶与医学的关系
了解 酶在探讨疾病发生机理、疾病诊断、疾病治疗中的作用。
第二十章 维生素
第一节 脂溶性维生素
(一)掌握 维生素A、D、E、K的生理功能;维生素A、D、E、K
缺乏症。
(二)熟悉 维生素A、D、E、K中毒症。
(三)了解 维生素A、D、E、K的化学结构和性质。
第二节 水溶性维生素
(一)掌握 B族维生素、C的生理功能; B族维生素、C的缺乏症。
(二)了解 B族维生素、C的化学结构和性质。
第二十一章 钙、磷及微量元素
第一节 钙、磷代谢(自学)
(一)熟悉 钙磷在体内的分布;钙磷代谢的调节。
(二)了解 影响钙磷吸收的因素。
第二节 微量元素
(一)掌握 微量元素的概念,微量元素的生理功能。
(二)了解 微量元素的含量、分布及作用。
第二篇 物质代谢及其调节
第五章 糖代谢
第一节 糖的摄取与利用
(一)熟悉 糖的生理功能;小肠黏膜细胞摄取葡萄糖的机制,葡萄糖转运蛋白。
(二)了解 糖在体内的消化、吸收与转运。
第二节 糖的无氧氧化
(一)掌握 糖酵解的概念;糖的无氧氧化的部位、两个阶段;糖酵解三个不可逆反应及关键酶;底物水平磷酸化概念及能量生成;2,6-二磷酸果糖是磷酸果糖激酶-1最强的激活剂;糖的无氧氧化生理意义及能量ATP的生成。
(二)熟悉 熟悉糖酵解基本反应过程。
(三)了解 关键酶在糖酵解代谢调控中的基本作用模式;其它单糖进入糖酵解途径。
第三节 糖的有氧氧化
(一)掌握 糖的有氧氧化,糖的有氧氧化的三个阶段及发生部位;丙酮酸脱氢酶复合体及辅酶组成;三羧酸循环(TCA)的概念、限速反应及关键酶、代谢产物等基本要点;糖有氧氧化中各阶段ATP生成的数目和方式;
(二)熟悉 TCA具体反应过程及生理意义;细胞能量状态在有氧氧化调控过程中的核心作用。
(三)了解 丙酮酸氧化脱羧反应过程;关键酶在糖有氧氧化各阶段的基本调控模式;巴斯德效应的概念及其机理,瓦伯格效应。
第四节 磷酸戊糖途径
(一)掌握 磷酸戊糖途径发生的细胞部位、关键酶、中间产物NADPH和5-磷酸核糖;磷酸戊糖途径的主要生理意义。
(二)了解 磷酸戊糖途径的两个反应阶段;NADPH/NADP+比值对磷酸戊糖途径的调节作用;蚕豆病的发生机理。
第五节 糖原的合成与分解
(一)掌握 葡萄糖在体内的储存形式及生理意义;糖原合成的概念、亚细胞定位、“活性葡萄糖”形式及关键酶;肝糖原分解的概念、亚细胞定位、关键酶及产物形式;肝糖原、肌糖原分解代谢差异与其不同生理功能上的关系。
(二)了解 糖原的基本结构特点;糖原合成的基本过程、糖原引物、分支链形成等;原支链分解的过程;激素通过化学修饰调节对糖原合成与分解的协同调节作用;原累积症特点及成因。
第六节 糖异生
(一)掌握 糖异生的概念、原料及主要发生的器官;糖异生主要反应过程的关键酶;乳酸循环的概念、基本过程及生理意义。
(二)熟悉 草酰乙酸的穿梭方式、NADH来源;底物循环及无效循环的概念;糖异生的生理意义。
(三)了解 糖异生调节主要在两个底物循环间进行调节。
第七节 葡萄糖的其他代谢产物
了解 糖醛酸途径,多元醇途径。
第八节 血糖及其调节
(一)掌握 血糖的来源、去路及其相对平衡的生理意义。
(二)熟悉 血糖的概念、参考正常值;
(三)了解 血糖稳态的调节;高血糖、糖尿病、低血糖的定义。
第六章 生物氧化
第一节 线粒体氧化体系与呼吸链
(一)掌握 线粒体氧化体系的组成,呼吸链(电子传递链)的概念,两条氧化呼吸链(NADH和FADH2氧化呼吸链)的排列顺序。
(二)熟悉 生物氧化的概念;递氢体和电子传递体的概念;组成呼吸链的四种酶复合体及其辅基的名称、排布、结构特点及功能。
(二)了解 生物氧化的特点;确定呼吸链各组分排列顺序的实验方法(还原电位、体外呼吸链拆开与重组、阻断试验、吸收光谱)。
第二节 氧化磷酸化与ATP的生成
(一)掌握 体内ATP生成的两种主要方式;氧化磷酸化和底物磷酸化的概念;P/O比值概念;高能磷酸键和高能磷酸化合物的概念;掌握ATP在体内能量转移和磷酸核苷化合物互变的核心作用。
(二)熟悉 由P/O比值和自由能变化(ΔGo/)确定的氧化磷酸化偶联部位;阐释氧化磷酸化偶联机制的理论——化学渗透假说;ATP合酶的结构特点;常见的几种重要的高能磷酸化合物及用。
(三)了解 ATP生成的结合变构机制。
第三节 氧化磷酸化的影响因素
(一)掌握 体内能量状态(ATP/ADP)是调节氧化磷酸化速率的主要因素;掌握不同组织(脑、肝、骨骼肌、心)胞质中NADH跨线粒体内膜的穿梭路径;
(二)熟悉 常见的呼吸链抑制剂、解偶联剂和氧化磷酸化抑制剂及其作用的机制;甲状腺激素对氧化磷酸化的影响机制。
(三)了解 线粒体DNA突变对氧化磷酸化功能的影响作用;α-磷酸甘油穿梭和苹果酸-天冬氨酸穿梭的基本过程;腺苷酸转运蛋白(ATP-ADP转位酶)的结构及对ATP、ADP的偶联转运。
第四节 其他氧化与抗氧化体系
了解 活性氧的概念及常见类型;微粒体细胞色素P450单加氧酶,活性氧产生的机制及其对机体的危害;体内常见的抗氧化酶类型及生理功能。
第七章 脂质代谢
第一节 脂质的构成、功能及分析
(一)掌握 脂质的生物功能,必需脂肪酸的概念及种类。
(二)了解 甘油三酯、脂肪酸、甘油磷脂及胆固醇的结构。
第二节 脂质的消化与吸收
了解 脂质的消化与吸收。
第三节 甘油三酯代谢
(一)掌握 脂肪动员和激素敏感性甘油三酯脂酶;甘油代谢及甘油激酶;脂肪酸的β-氧化基本过程及脂肪酸氧化中能量计算;酮体的概念,酮体生成和利用的部位、原料和关键酶,酮体生成的生理意义。甘油三酯合成的原料、部位、合成基本过程;软脂酸的合成原料、部位和限速酶;脂肪酸合成的调节。
(二)熟悉 软脂酸合成;酮体生成及利用的过程及调节。
(二)了解 软脂酸延长及不饱和脂肪酸的合成;多不饱和脂肪酸的重要衍生物;脂肪酸的其它氧化方式。
第四节 磷脂代谢
(一)熟悉 甘油磷脂的组成、分类及合成部位、原料;甘油磷脂的分解及磷脂酶的作用。(二)了解 甘油磷脂合成的过程;鞘磷脂的代谢。
第五节 胆固醇代谢
(一)掌握 胆固醇生成的部位、合成原料、关键酶、调节和胆固醇的转化。
(二)了解 胆固醇合成的过程。
第六节 血浆脂蛋白及其代谢
(一)掌握 血浆脂蛋白概念、用电泳法和超速离心法分离的种类、组成特点及生理功能。
(二)熟悉 血脂概念及组成;载脂蛋白CII、AⅠ、CETP及PTP的功能,各种血浆脂蛋白的代谢过程及相关酶LPL、ACAT、LCAT的作用。
(三)了解 脂蛋白的基本结构,血浆脂蛋白代谢异常。
第九章 蛋白质消化吸收和氨基酸代谢
第一节 蛋白质的营养价值与消化、吸收
(一)掌握 掌握氮平衡的三种情况;必需氨基酸;蛋白质的腐败作用。
(二)熟悉 蛋白质营养的重要性和需要量;蛋白质的互补作用,蛋白质的腐败。
(三)了解 蛋白质的消化、吸收。
第二节 氨基酸的一般代谢
(一)掌握 氨基酸代谢库;体内最重要的转氨酶(AST、ALT);转氨酶的辅酶;L-谷氨酸氧化脱氨基的酶及存在部位;一般联合脱氨基作用的进行部位及反应过程;“嘌呤核苷酸循环”的进行部位;a-酮酸三个主要代谢途径;生酮氨基酸。
(二)熟悉 真核细胞内两条重要蛋白质降解途径的基本情况;三类转氨基作用的概念。
(三)了解 组织蛋白质的寿命;嘌呤核苷酸循环的反应过程,其它脱氨基方式;生糖氨基酸、生糖兼生酮氨基酸。
第三节 氨的代谢
(一)掌握 体内氨的来源与去路;氨经血转运的两种形式;鸟氨酸循环部位、原料、限速酶及参与的氨基酸。
氨的转运和尿素生成。
(二)熟悉 CSP-Ⅰ的特点及激活剂;高血氨症的概念,肝性脑病的氨中毒学说。
(三)了解 尿素合成的调节。
第四节 个别氨基酸的代谢
(一)掌握 一碳单位的概念、种类、载体、来源;活性甲硫氨酸及生理功用;苯丙酮酸尿症和白化病缺乏的酶,酪氨酸在体内代谢生成的产物(包括甲状腺素)。
(二)熟悉 脱羧基产物;一碳单位代谢,一碳单位的互变情况及生理功能;甲硫氨酸循环过程、概念及生理意义,半胱氨酸的代谢产物;芳香族氨基酸的代谢。
(三)了解 氨基酸生成一碳单位的情况;肌酸的合成;尿黑酸尿症、帕金森病;Trp的代谢情况;Val、Leu及Ile的代谢概况。
第九章 核苷酸代谢
第一节 核苷酸代谢概述
(一)熟悉 核苷酸的生理功能。
(二)了解 核酸的分解、消化与吸收。
第二节 嘌呤核苷酸的合成与分解代谢
(一)掌握 嘌呤核苷酸从头合成参与的物质;嘌呤核苷酸抗代谢物的本质(嘌呤类似物、氨基酸类似物及叶酸类似物)、作用原理及各类的典型代表(包括与何种物质结构相似);嘌呤核苷酸分解代谢的终产物、过多导致的疾病、痛风的治疗药物和生化机制。
(二)熟悉 嘌呤核苷酸从头合成的概念、原料、特点、基本阶段及限速酶;从头合成的调节;补救合成的概念、生理意义。
(三)了解 从头合成的过程;嘌呤核苷酸的相互转变;嘌呤核苷的分解代谢过程。
第二节 嘧啶核苷酸的合成与分解代谢
(一)掌握 嘧啶类似物的典型代表及生化机制。
(二)熟悉 嘧啶核苷酸合成原料、特点和基本阶段,CTP、dTMP的生成
(三)了解 嘧啶核苷酸的分解代谢;嘧啶核苷酸从头合成过程;嘧啶核苷酸补救合成概况;嘧啶核苷酸分解代谢的终产物及特点。
第十章 代谢的整合与调节
第一节 代谢的整体性
(一)熟悉 物质代谢与能量代谢相互关联;糖、脂、蛋白质、核酸代谢之间的相互联系。
(二)了解 代谢的整体性。
第二节 代谢调节的主要方式
(一)掌握 代谢调节有三种方式;关键酶的概念及特点;别构调节的概念及特点;化学修饰调节的概念、特点及主要方式。
(二)熟悉 细胞内酶隔离分布的意义;饱食、饥饿状态下的整体调节。
(二)了解 酶含量的调节;激素水平的代谢调节;应激和肥胖的整体调节。
第三节 体内重要组织和器官的物质代谢特点
熟悉 组织、器官代谢的典型特点。
第十八章 血液的生物化学
第一节 血浆蛋白质
熟悉 血浆蛋白质的分类与性质及功能。
第二节 血红素的生物合成
(一)掌握 血红素的合成原料、部位、关键酶及其调节。
(二)了解 血红素合成的过程。
第三节 血细胞物质代谢
熟悉 红细胞的代谢特点。
了解 白细胞的代谢特点。
第十九章 肝的生物化学
第一节 肝在物质代谢中的作用
熟悉 肝在糖、脂类、蛋白质、维生素、激素代谢中的主要作用特点。
第二节 肝的生物转化作用
(一)掌握 生物转化作用的概念、意义及特点。
(二)熟悉 生物转化反应的主要类型及酶系;生物转化作用的特点及其生理意义。
(三)了解 非营养性物质的来源;影响生物转化作用的因素。
第三节 胆汁与胆汁酸的代谢
(一)掌握 胆汁酸的分类(游离胆汁酸,结合胆汁酸)、功能、代谢及关键酶,肠肝循环概念及其生理意义。
(二)了解 胆汁酸的化学性质与结构。
第四节 胆色素代谢与黄疸
(一)掌握 胆色素概念及种类;胆红素的生成与转运;未结合胆红素与结合胆红素异同。
(二)熟悉 胆红素在肝内的转变;胆红素在肠道中的转变和胆色素的肠肝循环;黄疸类型及生化改变。
(三)了解 胆红素的生成过程。
第三篇 遗传信息的传递
第十二章 DNA的合成
第一节 DNA复制的基本规律
(一)掌握 半保留复制的概念;DNA半保留复制的基本概念。
(二)熟悉 半保留复制的意义;DNA半保留复制的实验证据;DNA复制的起点、复制子的概念;复制的方向性;领头链、随从链、冈崎片段及半不延续复制的基本概念。
(三)了解 DNA复制的起点、双向复制及复制子的概念;半保留复制的意义。
二、教学内容:
第二节 DNA复制的酶学和拓扑学变化
(一)掌握 复制所需的底物、模板及聚合反应;大肠杆菌DNA聚合酶的不同种类和功能。
(二)熟悉 真核生物的DNA聚合酶的种类及功能;复制的保真性的三种机理及DNA聚合酶所起的作用;解螺旋酶、DNA拓扑异构酶、单链DNA结合蛋白在DNA复制中的主要作用;引物酶和引发体;DNA连接酶的作用。
(三)了解 复制化学反应。
第三节 原核生物DNA复制过程
熟悉 DNA复制的大致过程;引物酶和引发体。
第四节 真核生物DNA复制过程
(一)熟悉 真核生物端粒和端粒酶的组成及意义。
(二)了解 真核生物与原核生物DNA生物合成过程的不同点;真核生物DNA合成后核小体的组装;端粒酶的作用机制。
第五节 逆转录
(一)掌握 逆转录的概念及逆转录酶。
(二)熟悉 逆转录的过程。
(三)了解 逆转录的意义。
第十三章 DNA损伤与修复
第一节 DNA损伤
第二节 DNA损伤修复
(一)掌握 引发突变的因素;DNA的损伤与修复的种类及其机理。
(二)熟悉 DNA损伤的概念;DNA损伤的类型;导致DNA损伤的体内及体外因素;DNA损伤的直接修复、切除修复的种类及其作用机制。
(三)了解 DNA损伤的后果;DNA损伤的其他修复形式。
第十六章 RNA的合成
第一节 原核生物转录的模板和酶
(一)掌握 转录的概念、转录与复制的异同点;模板链、编码链的概念;启动子概念及其作用。
(二)熟悉 不对称转录的含义;大肠杆菌转录酶的组成、各亚基的功能、全酶与核心酶的组成和功能;RNA聚合酶辨认和结合的区域及序列特征。
第二节 原核生物的转录过程
(一)掌握 转录起始阶段、转录链的延长、转录链的终止概念。
(二)熟悉 转录起始阶段、转录链的延长、转录链的终止过程;原核生物转录起始复合物组成;原核生物转录终止的两种方式的区别。
(三)了解 转录延长的化学反应、转录延长的特点。
第三节 真核生物RNA的生物合成
(一)掌握 真核细胞转录酶的种类及转录产物,原核与真核生物转录延长的区别。
(二)熟悉 真核生物转录起始区的序列特点。
(三)了解 RNA聚合酶Ⅱ对真核生物的重要性;转录因子的作用、真核生物转录起始复合物的组成;真核生物的转录终止的特点。
第四节 真核生物前体RNA的加工和降解
(一)掌握 真核mRNA帽子、尾巴的结构,断裂基因、外显子、内含子的概念。真核生物前体mRNA的转录后加工。
(二)熟悉 真核生物tRNA的转录后加工。
(三)了解 真核生物mRNA加工过程;rRNA的特点,了解初级rRNA的加工概况(45S→18S、5.8S、28S)及特点;RNA在细胞内的降解途径
第十七章 蛋白质的合成(翻译)
第一节 蛋白质合成体系
(一)掌握 翻译的基本概念、参与蛋白质合成的原料;三联体密码子的概念、遗传密码的特点、mRNA在蛋白质合成中的作用;tRNA在蛋白质翻译中的作用;rRNA在翻译中的作用、核糖体上的重要的功能部位,熟悉核糖体大小亚基的功能。
(二)熟悉 移码突变的概念;原核生物肽链合成所需要的蛋白质因子。
(三)了解 真核生物肽链合成所需要的蛋白质因子。
第二节 氨基酸与tRNA的连接
(一)掌握 氨基酰-tRNA合成酶特点、氨基酸与tRNA结合时消耗能量,氨基酸活化的部位;真核和原核生物起始的氨基酰tRNA。
(二)了解 氨基酰-tRNA的书写;氨基酰-tRNA合成及其酶的催化的机理。
第三节 肽链的生物合成过程
(一)掌握 原核生物肽链延长的过程即进位-成肽-转位;肽链延长的能量消耗。
原核生物肽链合成的起始、肽链合成的延长、肽链合成的终止的基本概念。
(二)熟悉 原核生物起始复合物形成的基本过程、真核生物起始复合物形成与原核生物起始复合物形成的差别;核糖体循环的概念。肽链延长终止过程、释放因子的功能、原核生物释放因子所识别的终止密码子、多聚核糖体的概念。
(三)了解 真核生物起始复合物形成过程;真核生物肽链延长的过程。
第四节 蛋白质合成后的加工和靶向输送
(一)掌握 翻译后加工的概念、靶向输送的概念、分子伴侣的概念;信号肽的概念、信号肽的特点;肽链中氨基酸残基的化学修饰增加蛋白质功能多样性。
(二)了解 热激蛋白、伴侣蛋白的作用机制;肽链中氨基酸残基的化学修饰增加蛋白质功能多样性。
第五节 蛋白质生物合成的干扰与抑制
(一)熟悉 四环素、氯霉素、嘌呤毒素、放线菌酮抑制肽链生物合成的原理;白喉毒素抑制真核生物蛋白质合成的原理;干扰素的工作原理。
(二)了解 其他抗生素抑制肽链生物合成的原理。
第十六章 基因表达调控
第一节 基因表达调控的基本概念与特点
(一)掌握 基因表达的概念,顺式作用元件、反式作用因子的概念。
(二)熟悉 管家基因、基因组成性表达、诱导和阻遏表达的概念。
(三)了解 基因表达的时间特异性和空间特异性;基因表达调控的多层次和复杂性。
第二节 原核基因表达调控
(一)掌握 操纵子的概念;乳糖操纵子的结构,阻遏蛋白的负性调节,CAP的正性调节,协调调节。
(二)了解 原核基因表达转录终止阶段的调控机制;原核基因表达翻译水平的调控;转录衰减。
第三节 真核基因表达调控
(一)掌握 顺式作用元件、启动子、增强子、沉默子的概念和功能。
(二)熟悉 真核基因表达调控特点。染色质结构与真核基因表达密切相关。真核基因表达在翻译及翻译后的调控。
(三)了解 转录调节因子分类、结构;转录起始复合物的组成;真核生物的转录后调控。
第十七章 细胞信号转导的分子机制
第一节 细胞信号转导的概况
(一)熟悉 配体的概念、细胞外信号的类型及特点、受体的类型及各结合哪些具体的化学信号、信号转导通路的概念。
(三)了解 受体与配体结合对信号的转换、配体与受体作用的特点、信号转导网络。
第二节 细胞内信号转导分子
(一)掌握 信号转导分子的概念及分类、第二信使的概念;主要的第二信使如cAMP、cGMP、PIP2、DAG、IP3、Ca2+、NO的作用;G蛋白概念及其三聚体结构。
(二)熟悉 与第二信使相关的酶或蛋白如AC、GC、PDE、PI-K、蛋白激酶A、蛋白激酶C及Ca-M。
第三节 细胞受体介导的细胞内信号转导
(一)掌握 细胞内受体离子通道受体、G蛋白偶联受体传递信号的机理和细胞内受体信号通路、cAMP-PKA信号通路、IP3/DAG-PKC通路、Ca2+/钙调蛋白依赖的蛋白激酶通路。
(二)熟悉 三类膜受体的结构和功能特点;G蛋白循环。
(三)了解 酶偶联受体信号传递的基本过程。
第四节 细胞信号转导的基本规律
熟悉 细胞信号转导的基本规律。
第五节 细胞信号转导异常与疾病
掌握 霍乱毒素的作用机理。
第二十章 癌基因和抑癌基因
第一节 癌基因
第二节 抑癌基因
(一)掌握 癌基因、病毒癌基因和细胞癌基因的概念;抑癌基因的概念。
(二)了解 原癌基因的特点、活化机制及功能;生长因子的概念、分类、功能及作用机制;常见的抑癌基因。
第五篇 医学分子生物学专题
第二十三章 DNA重组及重组DNA技术
第一节 自然界的DNA重组和基因转移
(一)熟悉 基因重组过程和意义,接合、转化、转导作用,CRISPR/Cas系统。
(二)了解 基因重组的类型。
第二节 重组DNA技术
第三节 重组DNA技术在医学中的应用
(一)掌握 重组DNA技术、基因载体的概念。
(二)熟悉 熟悉限制性内切核酸酶和回文结构的概念,以及常用的克隆载体;重组DNA技术基本原理及操作步骤(目的基因的分离获取、载体的选择和构建、目的基因与载体连接、重组DNA转入受体细胞、重组体的筛选与鉴定、克隆基因的表达)。
(三)了解 重组DNA技术在医学中的应用。
第二十四章 常用分子生物学技术的原理及其应用
第一节 分子杂交与印迹技术
第二节 PCR技术的原理与应用
第三节 DNA测序技术 基因文库
第四节 生物芯片技术
第五节 蛋白质的分离、纯化与结构分析
第五节 生物大分子相互作用研究技术
(一)掌握 PCR的概念、原理及基本反应步骤。
(二)熟悉 探针的概念,印迹技术的原理及应用;DNA测序技术;
(三)了解 几种重要的PCR衍生技术;基因文库、基因组DNA文库和cDNA文库的概念;基因芯片和蛋白质芯片的概念。
第二十五章 基因结构与功能分析和疾病相关基因鉴定克隆
熟悉 基因结构分析的方法,基因功能研究的策略,疾病相关基因鉴定克隆的策略和方法。转基因技术、基因敲入、基因敲除、条件性基因敲除的概念;常用的基因沉默技术。
第二十六章 基因诊断和基因治疗
第一节 基因诊断
第二节 基因治疗
熟悉 基因诊断的概念;基因治疗的概念。
第二十七章 组学与系统生物医学
了解 组学的特点及在医学上的应用。
十、学时安排(见下表,含线上线下相结合授课安排表):
临床医学专业总课时100学时,其中线上学习10学时,线下集中授课66学时,实验课24学时。

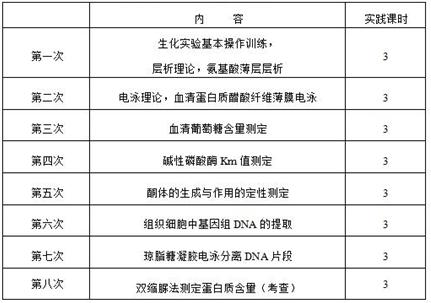
十一、实践教学内容安排:
绪论
怎样学好生物化学
蛋白质的结构与功能
蛋白质的结构与功能
氨基酸的分类
蛋白质的二级结构
蛋白质的理化性质
蛋白质的变性
课件-蛋白质的结构与功能
核酸的结构与功能
核酸结构与功能
核酸的化学组成以及一级结构
DNA双螺旋结构
真核生物mRNA的结构与功能
tRNA的结构与功能
核酸的理化性质
课件-核酸的结构与功能
酶
酶
可逆性抑制2
课件-酶与酶促反应
可逆性抑制11
维生素与无机盐
维生素
水溶性维生素1
水溶性维生素2
脂溶性维生素
课件-维生素
课件-钙磷代谢、微量元素
糖代谢
糖代谢
糖的无氧氧化
磷酸戊糖途径
柠檬酸循环
糖原的合成与分解
糖异生
血糖及调节
课件-糖代谢
生物氧化
生物氧化
影响氧化磷酸化的因素
化学渗透假说
课件-生物氧化
脂类代谢
脂类代谢
脂肪酸的beta氧化
酮体的生化
脂肪酸的合成
脂蛋白的结构和分类
磷脂代谢
脂蛋白的代谢
胆固醇代谢
课件-脂质代谢
氨基酸代谢
氨基酸代谢
蛋白质的生理功能和营养价值
氨基酸的脱氨基作用
尿素的合成
芳香族氨基酸的代谢
课件-氨基酸代谢
一碳单位代谢
核苷酸代谢
核苷酸代谢
嘌呤核苷酸的从头合成
课件-核苷酸代谢
物质代谢的联系与调节
物质代谢的联系与调节
血红素的合成
课件-物质代谢联系与调节
血液生化、肝的生化
血液生化、肝的生化
胆汁酸代谢
胆色素代谢
课件-血液的生物化学
课件-肝的生物化学
生物转化
DNA 的生物合成
DNA的生物合成
复制的基本特征
DNA复制体系
逆转录
课件-DNA生物合成
课件-DNA损伤修复
课件-真核基因
RNA 的生物合成
RNA的生物合成
RNA转录的体系
原核生物的转录起始
真核生物前体mRNA的加工
课件-RNA生物合成
蛋白质的生物合成
蛋白质的生物合成
蛋白质合成体系
翻译的起始翻译的起始过程
翻译延长过程
分泌蛋白质靶向运输
课件-蛋白质生物合成
核糖体循环
基因表达调控
基因表达调控
乳糖操纵子
顺式作用元件与反式作用因子
课件-基因表达调控
基因工程及其在医学中的应用
基因工程及其在医学中的应用
PCR的原理与过程
限制性核酸内切酶
基因工程
分泌蛋白质靶向运输
课件-DNA重组技术
课件-常用分子生物学技术
课件-癌基因 抑癌基因
课件-基因诊断基因治疗
课件-基因结构功能分析
课件-组学
细胞信息转导的分子机制
细胞信号转导
细胞信号转导
G蛋白及其作用机制
课件-细胞信号转导
G蛋白受体介导信号转导途径
生物化学教学大纲及考试样卷
生物化学考试相关
临床医学专业生物化学教学大纲2019-2
仁济学院临床医学等专业生物化学教学大纲2019-1
实验指导
药学类(含仁济学院)生物化学大纲2020-3
护理类(含仁济学院)生物化学大纲2020-3
临床公办类100学时-期末考试样卷
非公办临床类(含仁济学院)生化期末考样卷
生物化学实验指导及课件
生物化学实验指导
实验教学大纲(公办及仁济临床类)2018-9
(高教实验教材)医学生物化学与分子生物学实验指导
氨基酸薄层层析
血清蛋白质醋酸纤维薄膜电泳
血清葡萄糖含量测定
Km值测定
酮体的生成和利用
碱性磷酸酶的提取
双缩脲法测定蛋白质的含量
生物化学电子教材 思维导图
生物化学电子书
生物化学电子书 人卫第8版
生物化学思维导图
生物化学思维导图
护理+药学等专业---生物化学电子教材及PPT
电子书
第一章 蛋白质结构与功能
第二章 酶
第三章 维生素
第八章 核酸、核苷酸代谢
第四章 糖代谢
第五章 脂质代谢
第六章 生物氧化
第七章 蛋白质的分解代谢
第十章 DNA的生物合成
第十一章 RNA的生物合成
第十二章 蛋白质的生物合成
第十三章 基因表达调控
第十七章 血液与肝的生物化学
PPT
绪论
第一章 蛋白质结构与功能
第二章 酶
第三章 维生素
第四章 糖代谢
第五章 脂质代谢
第六章 生物氧化
第七章 蛋白质分解代谢
第八章 核酸 核苷酸代谢
第十章 DNA的生物合成
第十一章 RNA的生物合成
第十二章 蛋白质的生物合成
第十三章 基因表达调控
第十七章 血液与肝的生物化学
医学生物化学题库
医学生物化学题库
医学生物化学题库
2


